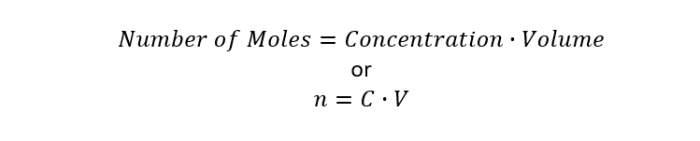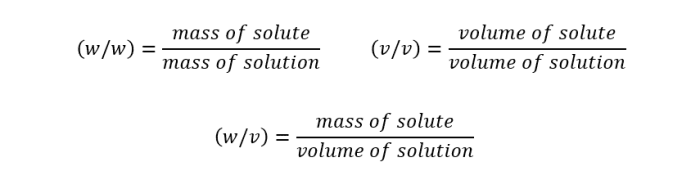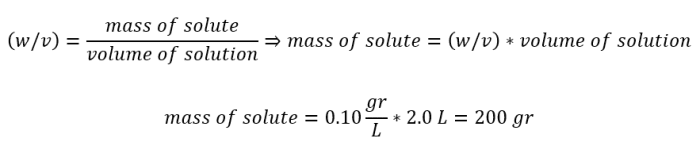如何在化学中解题
化学中的解是什么?
在化学中,溶液被定义为两种或两种以上化合物的均匀混合物,其中一种化合物是溶剂,其他化合物是溶质。根据经验,质量最大的化合物被认为是溶质。
溶剂与溶质的比值通常用两种方法表示。摩尔浓度(摩尔/升)或重量与体积的百分率,如重量/重量、重量/体积或体积/体积。
在下面的例子中,我将使用一种含有水的溶质作为溶剂,但我们将看到同样的原理适用于含有多种溶质的溶液。
通过溶解盐来创造化学溶液
这是一般化学中最常见的溶液类型,其中可溶性盐(任何可溶性离子化合物)溶解在一定数量的水中。
1.确定所需溶液的体积和浓度
第一步总是要确定你需要的溶液有多强,需要多少。一个好的规则是创造比你的实验需要的多一点,因为总是会有一些损失。
对于这个例子,我将假设我们需要,无论出于什么原因,使用三份150ml的0.20 M KOH溶液。这意味着我总共需要450毫升。因为我想要多一点,我要做500ml所需的溶液。
2.确定如何找到所需的溶质质量
一旦你知道了溶液的浓度和量,你就可以开始计算出需要多少化合物才能溶解在所需的体积里。为了做到这一点,我们使用两个方程的组合。
首先,我们需要说明浓度与溶剂的摩尔量和溶液体积的关系的方程。这个方程是:
浓度的单位是摩尔/升,体积的单位是升。
由这个方程,我们可以看出,首先必须求出溶质的摩尔量。为了做到这一点,我们使用了显示化合物质量,摩尔质量和摩尔量关系的方程,即:
质量单位是克,摩尔质量单位是克/摩尔。
然后从这个方程我们还需要我要用的化合物的摩尔质量。
3.求化合物的摩尔质量
化合物的摩尔质量就是组成该化合物的所有元素的摩尔质量之和。最简单的方法是找出分子中每种元素的类型和数量,找出每种元素的摩尔质量,然后把它们加在一起。
你可以从元素周期表中找到每种元素的摩尔质量。K的摩尔质量是39.1克/摩尔,O的摩尔质量是16.0克/摩尔,H的摩尔质量是1.01克/摩尔。
因此KOH的摩尔质量为39.1 + 16.0 + 1.01 = 56.1克/摩尔。
4.计算所需溶质质量
利用这两个方程和任意化合物的摩尔质量,你就可以计算出任意溶液的质量。
回到刚才的例子。我需要500ml 0.20 M KOH溶液。为了找到我需要称量的量,我使用下面的计算方法。
因此,要制作500ml 0.20 M KOH溶液,我需要将5.6克KOH溶解在500ml蒸馏水中。
当我称量KOH时,我应该尽量接近5.6克,但这并不意味着我需要精确地称5.6000克。重量为5.588克或5.615克是可以接受的,因为解的精度只需要达到两位数。
5.混合溶质和溶剂
一旦你测量出你打算溶解的化合物的正确量,你应该把它放在一个容量瓶里。这是一个特殊的烧瓶,有一条线表示烧瓶的标签体积的精确位置。
将溶质放入烧瓶中,然后倒入蒸馏水。把塞子放进去,摇晃烧瓶,直到溶质完全溶解。接下来,在烧瓶中倒入蒸馏水,直到接近水平线,然后用吸管小心地加水,直到水平线。塞子瓶再次,摇晃它一点,标签瓶正确,你就完成了。
在调整体积之前,首先溶解溶质是很重要的,因为在许多情况下,溶质会通过增加或减少来影响溶液的最终体积。例如,如果你将50毫升水和50毫升乙醇混合,你最终会得到大约98毫升的溶液。
有多种溶质
如果你的溶液中有不止一种溶质,那么你需要执行步骤1。- 4。对于你所使用的每种溶质。最终的溶液将是几种不同溶质的混合物。
例如,我们可以将0.10 mol KOH和0.20 mol NaCl溶解在蒸馏水中。然后,我们将在烧瓶上标记每种溶剂的浓度(0.10M KOH + 0.20M NaCl)或每种离子的浓度(0.10M K)+, 0,10米哦-, 0.20 M Na+, 0.20 M Cl-).
利用质量体积比创建化学溶液
有时使用质量体积比来解决问题是很有用的。在大多数情况下,生成这些解的步骤是相同的,但计算方法是不同的。
1.确定所需溶液的体积和浓度
和前面一样,第一步是确定你需要的溶液有多强,需要多少。
对于第二个例子,我将假设我们需要制作2.0L 10% (w/v) NaCl溶液。
(w/v)表示溶质的质量是溶液体积的10%的数值,在这种情况下是100g / 1000ml。
10% (w/w)意味着我们需要一个溶液,其中10%的溶液质量来自NaCl, 10% (v/v)意味着溶质的体积是溶剂总体积的10%。
2.确定如何找到所需的溶质质量
这里我们可以用简单的比率方程。我们只需要小心使用正确的一个。
3..计算所需溶质质量
对于这种溶液,我们不需要知道溶质的摩尔质量。使用这些方程,你可以计算出任何你想要的溶液的质量。
回到第二个例子。我需要2.0 L 10% (w/v) NaCl溶液。为了找到我需要称量的量,我使用下面的计算方法。
因此,要制作2.0 L 10% (w/v) NaCl溶液,我需要称出200克NaCl。同样,精度只需要在两位数字上,所以重量199.5克或200.9克在这种情况下就可以了。
4.混合溶质和溶剂
一旦你测量出你想要溶解的化合物的正确量,你应该像以前一样把它放在容量瓶里,然后按照前面讨论的相同步骤进行。
©2020 Jon Sigurdsson
评论
莉斯韦斯特伍德2020年1月12日,英国:
这让我想起了化学课,尽管我承认它从来都不是我最擅长的学科。
艾尔2020年1月12日:
伟大的文章,我从来不是化学的粉丝,我似乎从来没有得到正确的浓度和体积,能够产生所需的颜色指示。即使离开了化学领域,我仍然会做噩梦。